今天我们要聊一聊这个牛得飞起,以一己之力撑起GCSE和A-level化学几乎1/2考点的神奇的元素:碳 (carbon)。

燃烧反应,化石燃料,有机合成,生物大分子,烷烯醇醛酮酸酯等等听起来高大上但是不知道是啥的东西都跟碳这种元素紧密相关。今天我们就从简单的入手,来一起看一看由碳原子组成的几种大型共价化合物。
1、金刚石
大型共价化合物几乎是GCSE和A-level化学年年必出的考点,而且各大考试局在这一点上是惊人的一致。我们第一个要说的物质就是金刚石。金刚石又被称为钻石,是世界上最坚硬也最昂贵的物质之一。金刚石是一种完全由碳原子互相连接形成的化合物,从原子的层面看跟碳块没什么区别。是不是突然觉得钻石变得low了一些了(手动微笑)。


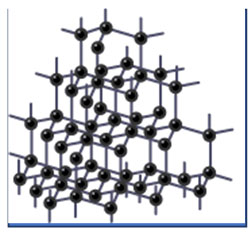

金刚石的结构如上图所示,是一种大型共价化合物(giant covalent substance)每个碳原子都跟其他四个碳原子通过共价键相连,共同形成了一个正四面体型网状结构。在碳原子之间没有任何游离电子,结构画出来堪比密恐福利。由于这种由数以亿计的强力共价键的作用,使得打开金刚石内所有的化学键需要消耗巨大的能量。这也是为什么金刚石如此坚硬的原因。由于金刚石的这一特征,使得它成为了切割物体的神器,比如说玻璃刀或是油井钻头。
2、石墨
石墨和金刚石虽然同出一门,但是在非科学界里,无论是从颜值和逼格上来看都被金刚石按在地上狠狠摩擦。因为他俩一个长这样:

一个长这样:

相比同样由碳原子构成的金刚石而言,石墨的长相显然更符合碳这一元素的定位。跟金刚石一样,石墨也是一种大型共价化合物,每个碳原子跟其他三个碳原子通过共价键相连,在一起形成了一层一层的正六边形网状结构。由于碳的最外层有4个电子,这里只用3个,所以剩下的一个电子就形成了游离电子(free electron)。这些游离的电子在通电的时候就会自由移动形成电流。这也是石墨能够导电的原理。而且石墨的层与层之间只有非常弱的分子间作用力,跟共价键相比不需要太大的能量就能打开。所以也让石墨非常的软,更加容易切割和加工。他们俩的坚硬程度相比大概是这样的:

由于石墨可导电的特性,使得石墨是很好的制作电极的材料。又因为石墨层与层之间可以滑动,使得石墨非常的滑,是一种很好的润滑剂,还可以用来制造铅笔。石墨还可以当作炸弹投掷到一些非常重要的工业场所,利用它的强导电性来造成短路,引起大规模的断电。这招美军曾经在海湾战争使用过。
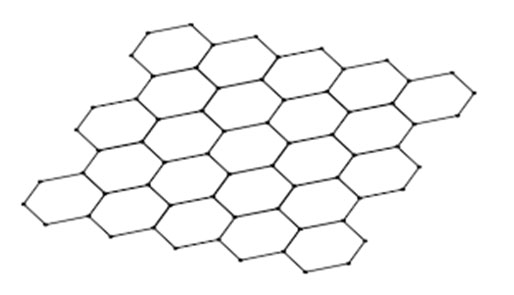
3、石墨烯
石墨烯是另外一种碳的形态,它的结构说白了就是单层的石墨。石墨烯有着非常高的熔点而且非常的强壮。这是因为碳原子之间是由强共价键连接的,想断掉这些键需要很大的能量。就像是石墨一样,石墨烯也是非常好的导体,原因也是因为自由电子可以在通电的时候自由移动从而形成电流。
4. 富勒烯
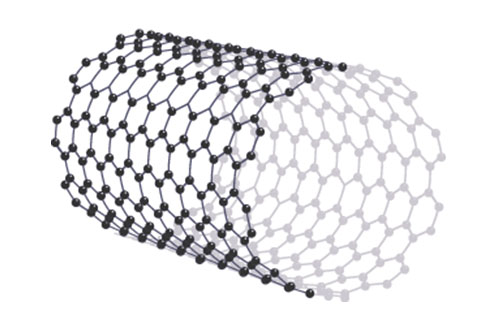
富勒烯也是碳元素的大分子形态。有两个富勒烯的例子:纳米管和巴基球。
纳米管顾名思义,是纳米级的一个小小的管子。它是由一层石墨“卷起来”形成的一个筒形的结构。纳米管的韧性很强,所以纳米管非常的坚韧也没办法被拉伸。就像是石墨烯一样纳米管也可以导电,因为他们也有:
可以移动的自由电子!
大家有没有发现,凡是有能够自由移动的电子或其他带电粒子的结构无一例外都可以导电,这也是在A-level中一个非常重要的概念。纳米管的结构如下图,让人有种想拿他卷烤肠的冲动呢。
另一类富勒烯就是巴基球。巴基球的结构如下图所示,是一个球形或椭圆形的由碳原子组成的大分子。
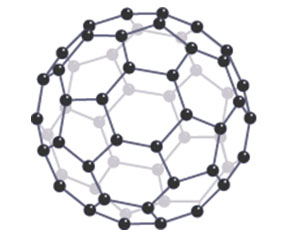
巴基球是这里面唯一一个不是网状结构的大分子,说明巴基球的大小是可以用多少个碳原子数来表达的。比如说由60个碳原子构成的巴基球就可以称作碳六十。不同的巴基球之间会有很弱的分子间作用力相连。想断掉这些分子间作用力不需要很多的能量,所以一般来说由巴基球构成的物资都比较滑,然后熔点也比钻石和石墨低很多。
以上就是几种由碳原子构成的大型共价化合物的结构讲解。希望能对各位的学习有些帮助!