一直以来,晶体的熔沸点都是一个非常重要,并且考试中经常会出现的一个AP化学知识点,为了帮助同学们更好的理解这部分内容,本文对离子晶体(ionic solid),原子晶体(covalent network),和分子晶体(molecular solid)的熔沸点进行对比,一起来了解一下吧!
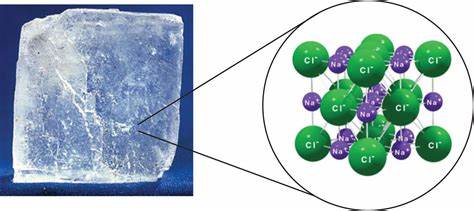
离子晶体(ionic solid)
电负性差异较大的原子相互接近会发生电子得失,形成阴阳离子,阴阳离子之间因为库仑力(coulombic force)形成的化学键即为离子键(ionic bond)。由离子键形成的的晶体叫离子晶体。离子晶体不存在单个的分子,其阴阳离子紧密堆积,向空间无限延伸,是故要使其熔化或者沸腾,需要克服离子键,因此离子键越强的晶体,也具有较高的熔沸点。
离子键的强弱受两个因素的影响:第一个因素是电荷,电荷越大,离子键越强;第二个因素是半径:半径越小,离子键越强。在AP化学考试中优先比较电荷,只有当电荷相同的时候,再去比较半径。下图是一个例子:
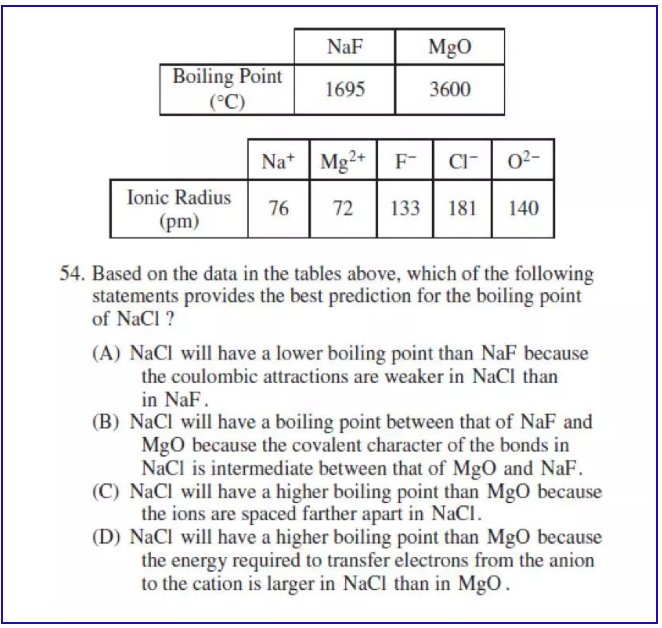
解题思路:
从题干本身来看,我们会发现MgO的阴阳离子电荷高于NaF,所以其沸点也远高于NaF。从问题来看,NaCl和NaF相比,它们电荷数相同,Cl离子半径大于F离子半径,所以NaCl的沸点低于NaF沸点,所以该题选A.
分子晶体(molecular solid)
分子晶体是由分子间作用力构成的晶体,要使其熔化或者沸腾,只需要克服分子间作用力即可。分子间作用力越强的分子晶体,其熔沸点也越高。分子间作用力从强到弱分为氢键(hydrogen bond),偶极力(dipole-dipole force)和伦敦色散力(london dispersion force).氢键是O,N,F的氢化物之间的作用力,偶极力是极性分子之间的作用力,伦敦色散力是非极性分子之间的作用力。而对非极性分子而言,如果电荷数越多,则电荷运动过程中越容易发生不均匀分布(即更为polarizable),伦敦力越强,熔沸点越高,这也是为什么在常温下卤族元素中F和Cl形成的单质为气体,Br2为液体,I2为固体。以一道真题举例:
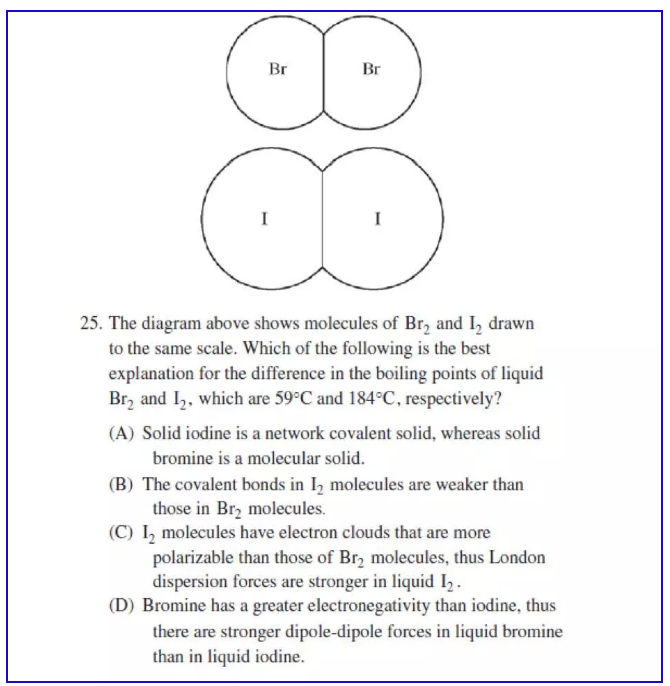
解题思路:
I2和Br2是非极性分子,分子间是伦敦色散力,I2具有更多的电子,更加polarizable,所以伦敦力更强,表现为沸点更高。选C.
再来看一道考题:
解题思路:
由于氢键>偶极力>伦敦力,所以1-propanol的沸点最高,acetone第二,butane最低,选B.
原子晶体
原子晶体(covalent network)是由共价键连接而成的无限延展的网状结构,要使其熔化或者沸腾,必须破坏共价键,由于原子间相互结合的共价键非常强,所以原子晶体熔沸点也非常高。所以AP化学考试中,在不同晶体间进行熔沸点比较的时候,原子晶体>离子晶体>分子晶体。常见的原子晶体有金刚石晶体,单质硅,SiO2等。举例而言:

解题思路:
因为SiO2是原子晶体,所以熔沸点最高,所以选C.
以上就是A加未来小编关于AP化学知识点中关于晶体熔沸点的解析,同学们是不是对这部分内容完全掌握了呢?如果在AP化学学习中还有什么疑问或者困惑,可以随时联系A加未来线上老师,让专业的国际课程老师一对一为你进行针对性的辅导吧!